Malaria
A malária é uma doença causada por parasitas obrigatoriamente intracelulares, do filo Apicomplexa e do gênero Plasmodium (CROMPTON et al., 2014).
Os seres humanos podem ser infectados com um (ou mais) das cinco espécies de Plasmodium. São elas: P. falciparum, P. vivax, P. ovale, P. malariae e P. knowlesi (JAIN et al. 2014). Os plasmódios são transmitidos principalmente pela picada de uma fêmea infectada do mosquito Anopheles, no entanto infecções pelo parasita também podem ocorrer através da exposição ao sangue infectado (transfusão) e da transmissão congênita (de mãe para o feto). Nos países industrializados, a maioria dos casos de malária ocorrem entre viajantes, imigrantes, ou militares retornando de áreas endêmicas da doença (TRAMPUZ et al., 2003).
Segundo a World Health Organization (2012), em 2012 ocorreu cerca de 207 milhões de casos de malária em todo o mundo, com aproximadamente 627 mil casos de óbitos.
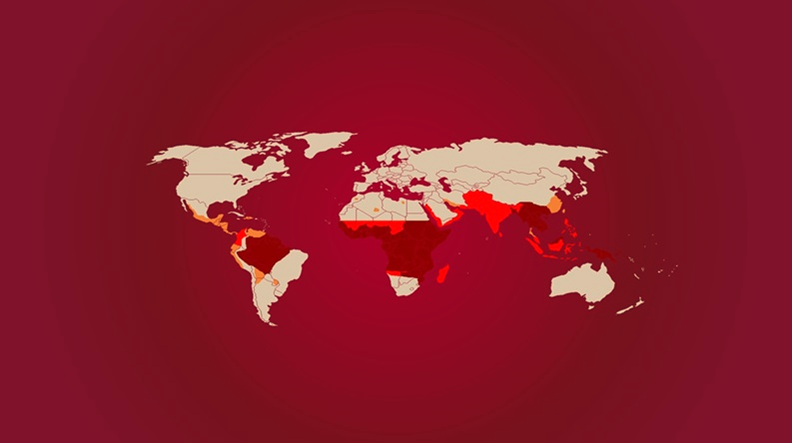
US Centers for Disease Control and Prevention, 2010.
Os sintomas da malária incluem febre, dor de cabeça e vômitos, e geralmente aparecem entre 10 e 15 dias após a picada do mosquito (WHO, 2012).
O parasita da malária se desenvolve tanto em humanos como em mosquitos Anopheles fêmeas. O tamanho e complexidade genética do parasita em uma infecção ocorre devido a apresentação de milhares de antigénios para o sistema imunológico humano. O parasita também se altera através de várias fases da vida, mesmo quando no hospedeiro humano, apresentando diferentes antígenos em diferentes estágios de seu ciclo de vida. Entendendo que estes podem ser um alvo útil para o desenvolvimento de vacinas, tem sido complicado a procura de mecanismos para bloquear a ação do parasita no organismo humano, pelo fato dele desenvolver uma série de estratégias que lhe permitem confundir, ocultar e desorientar o sistema imunológico humano (BAER et al., 2007).
Ciclo de vida da malaria
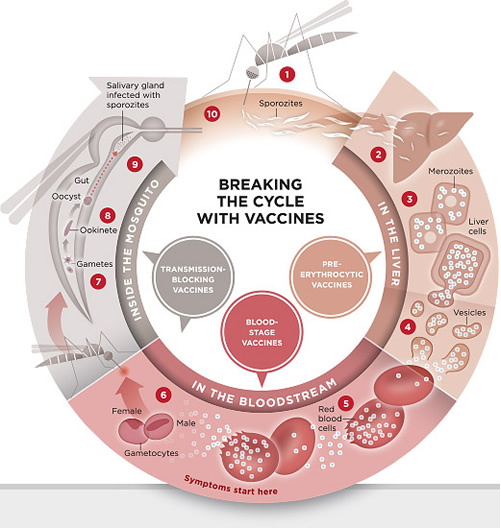
BAER et al., 2007
1. A Infecção da malária começa quando uma fêmea infectada do mosquito Anopheles pica uma pessoa, injetando parasitas Plasmodium, na forma de esporozoítos, na corrente sanguínea.
2 . Os esporozoítos passam rapidamente para o fígado humano.
3. Os esporozoítos multiplicam assexuadamente nas células do fígado nos próximos 7 a 10 dias, sem causar sintomas.
4 . Em um modelo animal, os parasitas, na forma de merozoítos, são liberados das células hepáticas em vesículas, seguindo na circulação através do coração até chegarem nos pulmões, onde se estabelecem dentro de capilares pulmonares. As vesículas eventualmente se desintegram, liberando os merozoítos para entrar na fase de desenvolvimento no sangue.
5 . Na corrente sangüínea, os merozoítos invadem as hemácias e multiplicam novamente até romperem a membrana das células. Em seguida, eles invadem mais hemácias. Este ciclo é repetido, causando febre cada vez que os parasitas se liberam e invadem as células do sangue.
6 . Algumas das células sanguíneas infectadas saem do ciclo de multiplicação assexuada . Em vez de replicar, os merozoítos nestas células se desenvolvem em formas sexuais do parasita, denominadas gametócitos, que circulam na corrente sanguínea.
7. Quando um mosquito pica um humano infectado, ele ingere os gametócitos, que se desenvolvem mais em células sexuais maduras chamados gametas.
8. Os gametas femininos fecundados desenvolvem em ookinetes que escavam através da parede do intestino médio do mosquito e formam oocistos na superfície exterior do intestino se movendo ativamente.
9. Dentro do oocisto, milhares de esporozoítos ativos se desenvolvem. O oocisto finalmente eclode, liberando os esporozoítos na cavidade do corpo que migram para as glândulas salivares do mosquito.
10 . O ciclo de infecção humana começa de novo quando o mosquito pica outra pessoa.
Malária submicroscópica importada em Madrid
A malária é geralmente diagnosticada através de métodos microscópicos (esfregaços de sangue) ou por métodos de imunocromatografia. Estes procedimentos são usados rotineiramente na prática clínica, mas têm sensibilidade limitada (RAMÍREZ-OLIVENCIA et al. 2012). Os testes de detecção rápida (RDTs) têm facilitado consideravelmente o diagnóstico da malária, porém eles apresentam muitas limitações como variabilidade nos resultados, sendo não quantitativa e ter estabilidade de armazenamento pobres em regiões tropicais. Em ordem para desenvolver um ensaio eficiente para o diagnóstico da malária, é necessário uma profunda compreensão como pré-requisito os sobre vários biomarcadores relacionados com a malária (JAIN et al. 2014).
A Malária submicroscópica (SMM) é definida como infecções de baixa densidade de Plasmodium que são dificilmente detectadas por microscopia convencional (RAMÍREZ-OLIVENCIA et al. 2012).
A Nested-PCR (Reação da Cadeia da Polimerase) é um método de diagnóstico molecular que permite a avaliação do gênero e da espécie específica de Plamodium através de regiões altamente conservadas dentro do DNA (FUEHRER et al., 2011). Atualmente a Nested PCR
vem sendo comumente utilizada como uma técnica de referência, devido à sua alta sensibilidade e especificidade no diagnóstico da
malária (IGLESIAS et al., 2014).
Metodologia
No trabalho de Olivencia (2012) foi realizado um estudo retrospectivo baseado na revisão de prontuários médicos. A população do estudo foi composta por pacientes com idade superior a 15 anos atendidos na Unidade do Hospital Carlos III da Medicina Tropical , entre 1 de Janeiro de 2002 a 31 de dezembro de 2007 . Foram utilizados técnicas rotineiras na detecção de Plasmodium como coloração campo e exame microscópico de esfregaço de sangue de aspecto grosso e fino. A malária multiplex semi - nested PCR foi utilizada para diagnosticar ou confirmar casos com baixa parasitemia (SMM).
Obs.: Um paciente só foi descrito como infecção por malária quando o Plasmodium spp. pode ser detectado através de microscopia convencional e/ou usando PCR, independentemente da presença de sintomas. Afirmou com SMM quando este apresentou um teste de PCR positivo, mesmo que o exame de esfregaço por microscopia de luz fosse negativo. Casos detectados pela microscopia convencional foram considerados como a malária microscópica (MM).
Resultados
Foram confirmados e incluídos 293 casos de malária neste estudo. Dos 189 casos (64,5%) foram classificados como MM e 104 casos (35,5%) como SMM. A média de idade foi de 40,38 anos e a distribuição por sexo foi semelhante. A maioria dos casos foram de imigrantes , mas alguns casos foram encontrados em viajantes. Guiné Equatorial foi o principal país onde a infecção foi adquirida (81,7%). O quadro abaixo descreve as caracterísiticas dos casos de malária total e por grupo.
RAMÍREZ-OLIVENCIA et al. 2012
A Tabela 3 mostra as características epidemiológicas da MM e SMM. Grupos Semi-imunes (nativos, residentes em
zonas endémicas e nativas-viajantes) foram mais frequentes no SMM que em MM. Quimioprofilaxia antimaláricas tinha sido tomada em 15,9% dos casos de malária microscópicas (30 de 189), enquanto que apenas em 5,8% dos casos de SMM (6 de 104). Uma análise mais aprofundada revelou que apenas 10% dos pacientes que sofrem de MM alcançaram boa adesão à quimioprofilaxia (3 casos em 30), em comparação ao 66,7% dos pacientes afetados pela SMM (4 casos de 6). Outras infecções parasitárias foram mais freqüentes no grupo SMM, mas não se encontraram diferenças sobre infecções por HIV, vírus da hepatite B (HBV) ou do vírus da hepatite C (HCV).
RAMÍREZ-OLIVENCIA et al. 2012
Foram observados sintomas presentes em 28,8% de todos os casos de SMM, os principais sintomas incluíram astenia (73,3% dos pacientes sintomáticos), febre (60%) e artromialgias (53,3%). As anormalidades laboratoriais associadas foram anemia (27,9%), leucopenia (15,4%) e trombocitopenia (15,4%) . Casos de co-morbidade foram descritos em 75 casos (72,1%). O quadro abaixo demonstra outros sintomas avaliados na classificação clínica dos pacientes quanto a MM e SMM.
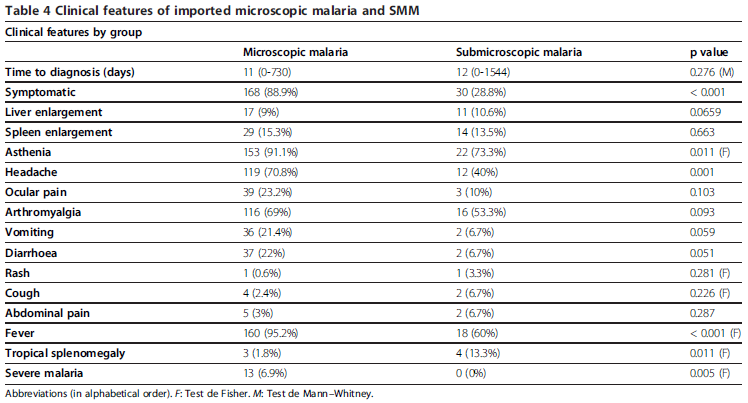
RAMÍREZ-OLIVENCIA et al. 2012
A Tabela 5 mostra os valores analíticos de alguns testes de sangue e na Figura 1 a comparação de anormalidades laboratoriais. Foram detectados mais casos de trombocitopenia e insuficiência renal nos pacientes que sofrem de MM do que em pacientes SMM. Anemia, leucopenia e icterícia casos foram semelhantes em ambos os grupos.
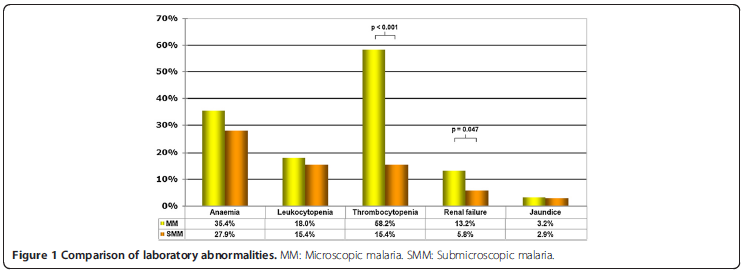
RAMÍREZ-OLIVENCIA et al. 2012
Discussão
Este estudo teve como objetivo descrever a freqüência de SMM importado e suas características epidemiológicas, clínicas e laboratoriais. A maioria dos casos de malária importada relatados na Europa são de MM e poucos casos relatados são de SMM. Duas principais razões importantes explicam esse fato: a) é suspeita de malária quando os sintomas estão presentes e b) O diagnóstico geralmente é feito por exame microscópico, sendo que a PCR não é usada rotineiramente. No entanto, este estudo não foi possível estimar a prevalência de SMM na população cuidada, porque as técnicas de PCR não foram sistematicamente realizada para todos os pacientes. No entanto, os autores acreditam que a SMM é uma doença freqüente representando até o terço de todos os casos de malária importada.
Conclusão
O diagnóstico da SMM é extremamente importante quando as anormalidades clínicas ou analíticas permanecem inexplicadas em um paciente proveniente de zonas endémicas para a malária. O diagnóstico da SMM é imprescindível pois a não detecção e o não tratamento pode levar à propagação de vetores competentes podendo causar o ressurgimento da malária na Europa.
Referências
BAER, Kerstin et al. Release of hepatic Plasmodium yoelii merozoites into the pulmonary microvasculature. PLoS Pathog, p. 171, vol. 3, nº 11, nov. 2007.
CROMPTON, Peter D. et al. Malaria Immuniy in Man and Mosquito: Insights into Unsolved Mysteries of a Deadly Infectious Disease. Immunology, p. 157-87, vol. 32, mar. 2014.
FUEHRER, Hans-Peter et al. Novel Nested Direct PCR Technique for Malaria Diagnosis Using Filter Paper Samples. Journal of Microbiology, p. 1628–1630, vol. 49, nº 4, apr. 2011.
IGLESIAS, Nuria et al. Performance of a new gelled nested PCR test for the diagnosis of imported malaria: comparison with microscopy, rapid diagnostic test, and real-time PCR. Springer-Verlag Berlin Heidelberg, apr. 2014.
JAIN, Pryamvada et al. Potential Biomarkers and Their Applications for Rapid and Reliable Detection of Malaria. BioMed Research International, p. 1-20, feb. 2014.
Malaria. US Centers for Disease Control and Prevention (April 15, 2010). Disponível em:< https://www.cdc.gov/malaria/ >. Visualizada em: 26 de Maio de 2014.
RAMIREZ-OLIVENCIA, Gérman et al. Imported submicroscopic malaria in Madrid. Malaria Journal, p. 324, vol. 11, sep. 2012.
TRAMPUZ, Andrej et al. Clinica review: Severe malaria. Critical Care, p. 315-23, vol. 7, nº 4, apr. 2003.
WHO, World Health Organization Malaria. Disponível em: < https://www.who.int/malaria/en/ >. Visualizada em: 26 de Maio de 2014.